该项研究是一项多中心、开放标签的I期临床试验,旨在评估HMPL-506用于治疗血液恶性肿瘤的的安全性、药代动力学和疗效。该研究将分为剂量递增和剂量扩展两个阶段进行,计划纳入至少60名患者。主要研究者是中国医学科学院血液病医院王建祥医生和魏辉医生。
关于HMPL-506和Menin
HMPL-506是一种研究性的新型、高选择性靶向menin蛋白的口服小分子抑制剂。Menin 蛋白是一种控制基因表达和细胞信号传递的支架蛋白。混合谱系白血病 (mixed-lineage leukemia, "MLL", 亦称KMT2A) 重排和核磷蛋白1 ("NPM1") 突变在急性髓系白血病 (acute myeloid leukemia, AML) 中起关键作用。成人急性髓系白血病中的约5%伴有MLL重排,急性髓系白血病中的约30%伴有NPM1突变。目前的研究表明,抑制menin-MLL互相作用是治疗MLL重排和/或NPM1突变急性髓系白血病的可行策略。目前全球尚未有menin抑制剂获批上市。和黄医药目前保留HMPL506在全球的所有权利。
根据美国国家癌症研究所 (NCI) 的预测,2023年美国新增约20,380例急性髓系白血病,五年相对存活率为31.7%。在中国,2018年估计新增19,700例急性髓系白血病,到2030年预计将达到24,200例。
项目介绍
—
研究目的:
剂量递增阶段:
-评价HMPL-506在伴MLL重排和/或NPM1突变的复发/难治急性白血病患者中的安全性和耐受性。
-确定HMPL-506在伴MLL重排和/或NPM1突变的复发/难治急性白血病患者的最大耐受剂量(MTD)和/或II期临床研究推荐剂量(RP2D)。
剂量扩展阶段:评价HMPL-506在伴MLL重排和/或NPM1突变的复发/难治急性白血病患者中的安全性和疗效。
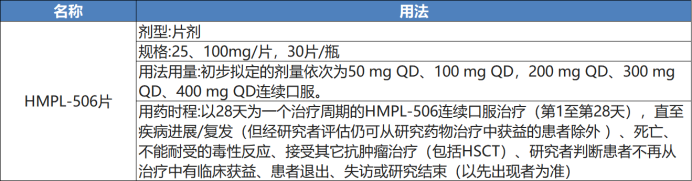
试验用药:
入选标准
—
1 对本研究已充分了解并自愿签署知情同意书
2 年龄≥18岁
3 1)剂量递增阶段:伴有MLL重排和/或NPM1突变的复发/难治AML或ALL患者(2022 WHO 髓系肿瘤和急性白血病分类标准确诊):2)剂量扩展阶段:以下三个队列,每个队列入组约10~20例 伴MLL重排和/或NPM1突变的复发/难治AML;伴MLL重排的复发/难治ALL ;复发/难治多发性骨髓瘤(MM,不需要进行生物标志物检测可筛选入组),伴有NUP214或NUP98融合等基因变异的AML
4 ECOG PS评分0-2分
5 同意在治疗前及治疗过程中进行骨髓穿刺抽吸和/或活检
6 有生育能力的女性患者必须同意从筛选至停止研究治疗后30天内使用高效的避孕方法,同时男性伴侣必须戴避孕套。更多信息详见附录11(有生育能力的女性(WOCBP)以及可接受和不可接受的避孕方法的定义)。并同意在此期间不以生殖为目的捐献卵子(或卵母细胞)。
7 性伴侣为有生育能力女性的男性患者必须同意在研究期间至研究药物停用30天内,性交时须使用避孕套。患者应当避免在研究期间至研究药物停用30天内捐献或冷冻精子。
排除标准
—
1 既往接受过Menin抑制剂治疗且出现治疗中进展的患者
2 有明确的活动性中枢神经系统(CNS)白血病(既往曾有 CNS 白血病已经治疗并控制,但需要筛选期进行腰椎穿刺脑脊液检查确认无CNS侵犯)
3 血清总胆红素高于正常值参考范围上限的1.5倍,但不包括以下患者:Gilbert疾病患者,并且丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)正常,血清总胆红素不高于正常值参考范围上限的3倍
4 肝脏无白血病侵犯时,ALT或AST高于正常值参考范围上限的3倍;白血病侵犯肝脏时,ALT或AST高于正常值参考范围上限的5倍(后一条件不适用于剂量递增阶段)
5 肾小球滤过率或依据Cockcroft-Gault公式估算的肌酐清除率<50 mL/min;(140 - 年龄) × (体重kg) ×(男性1,女性0.85) 72 ×(血清肌酐mg/dL)
6 国际标准化比(INR)高于正常值参考范围上限的1.5倍或部分活化凝血酶原时间(aPTT)高于正常值参考范围上限的1.5倍,正在接受抗凝治疗的患者不适用;
7 已知有显著临床意义的肝病病史,包括病毒性或其它肝炎: 乙型肝炎患者(HBsAg或HBcAb阳性),若HBV DNA的PCR检测结果为阴性则可入组,并且需要每周期进行HBV DNA检测;丙型肝炎患者,若HCV RNA的PCR检测结果为阴性则可入组;
8 已知人类免疫缺陷病毒(HIV)感染
9 妊娠(用药前妊娠检测阳性)或正处于哺乳期的女性
10 首次研究药物给药前6个月内有中风或颅内出血史
11 近5年内患有其他原发性恶性肿瘤的患者,下列接受过根治性治疗的非侵袭性肿瘤除外:皮肤基底细胞癌,皮肤鳞状细胞癌,宫颈原位癌,乳腺原位癌
12 符合下列任一条心脏功能相关标准: 各种有临床意义的心律异常或传导异常,需要临床干预; 遗传性长QT间期综合症或QTcF >470 msec;各种有临床意义的心血管疾病,包括入组前6个月内的急性心肌梗死、不稳定心绞痛、冠状动脉搭桥手术,美国纽约心脏病学会(NYHA)分级为III级以上(含III级)的充血性心力衰竭,左室射血分数(LVEF)<50%,或未控制的高血压,即收缩压>140 mmHg或舒张压>90 mmHg,或筛选期三次心电图平均心率>100次/分
13 研究治疗开始前2周内接受过系统性抗肿瘤治疗或放疗:对于外周血白细胞计数升高(WBC >25×109/L)的患者,允许在入组前及HMPL-506治疗中使用羟基脲控制外周血白细胞;预防性鞘内注射化疗药物(阿糖胞苷、地塞米松和甲氨蝶呤)预防中枢白血病除外
14 研究治疗开始前60天内接受过HSCT,或筛选时正在接受HSCT后的免疫抑制治疗,或伴有需要药物控制的移植物抗宿主病(GVHD)的患者:使用固定口服剂量和/或局部外用的糖皮质激素治疗皮肤GVHD的患者,可以入组。
15 研究治疗开始前1周内接受过有明确抗肿瘤活性中草药/中草药活性成分的治疗;
16 研究治疗开始前2周内(贯叶连翘为3周)或5个半衰期内(以更长的时间为准)服用过CYP3A4的强诱导剂或强抑制剂;
17 本研究治疗开始距既往参加过其它药物临床试验的最后一次用小分子药少于2周或大分子药物(如抗体类药物)少于4周;
18 距首次研究用药4周内进行过重大手术;
19 既往抗肿瘤治疗的毒性反应尚未恢复到≤1级水平(脱发除外);
20 未受控制的需要住院或静脉抗生素治疗的活动性感染(定义为尽管接受了适当的抗感染和/或其他治疗,但与感染相关症状/体征持续存在且未见改善);或筛选期间出现不明原因的发热>38.5℃(只有研究者判断是肿瘤热方可入组);若因为中性粒细胞减少且研究者认为需要接受静脉抗生素预防性用药时,可入组
21 无法口服药物,既往手术史或严重的胃肠道疾病如吞咽困难、活动性胃溃疡等,研究者认为可能影响研究药物的吸收;
22 研究者判断的患者参加本临床研究的依从性不足;
23 任何其它疾病,代谢异常,体格检查异常或有显著临床意义的实验室检查异常,根据研究者判断,有理由怀疑患者具有不适合使用研究药物的某种疾病或状态,或者将会影响研究结果的解读,或者使患者处于高风险的情况。
患者受益:
⭐可抢先获得国际前沿新药使用机会,对晚期肿瘤患者来说可能是新的生机;
⭐入组后相关的检查、治疗、用药均为免费,大大减轻家庭经济负担!
⭐大型三甲医院一线专家团队为你的治疗保驾护航!
注:做了基因检测的病友可以拿出报告看看,一旦存在突变,可以扫描下方二维码添加专员看看是否有机会接受国内新药治疗,看不懂的病友也可以添加专员解读报告。




 浙公网安备 33010602004553号
浙公网安备 33010602004553号


