4月6日,美国FDA宣布加速批准由第一三共(Daiichi Sankyo)和阿斯利康(AstraZeneca)联合开发的重磅抗体偶联药物(ADC)Enhertu(trastuzumab deruxtecan)用于治疗不可切除或转移性HER2阳性(免疫组化[IHC] 3+)实体瘤成年患者,这些患者已接受过先前治疗且缺乏满意的替代治疗选项。
之前新闻稿指出,Enhertu是首款具有不限癌种适应症的HER2靶向ADC疗法。值得注意的是,这项批准对于罹患HER2阳性的肿瘤患者尤为重要,因为专门针对这些患者进行临床试验的机会较为有限。

这次批准主要基于在192名经治、不可切除或转移性HER2阳性(IHC 3+)实体瘤成人患者中的疗效评估结果,这些患者参加以下三项多中心试验之一:DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02。
所有三项试验皆排除有间质性肺病(ILD)或需要类固醇治疗肺炎病史的患者,或着在筛选时患有ILD、肺炎或临床上显著心脏疾病的患者。试验还排除了具有活动性脑转移或ECOG体能状态>1的患者。入组患者持续接受治疗,直至病情进展、死亡、撤回同意或出现不可接受的毒性。
三项试验的主要疗效结果指标是确认客观缓解率(ORR),另一个疗效指标是缓解持续时间(DOR)。所有结果均由独立中央审评(ICR)基于RECIST v1.1标准进行评估。
在DESTINY-PanTumor02中,患者的ORR为51.4%(95% CI:41.7,61.0),中位DOR为19.4个月(范围1.3,27.9+)。
在DESTINY-Lung01中,ORR为52.9%(95% CI:27.8,77.0),中位DOR为6.9个月(范围4.0,11.7+)。
在DESTINY-CRC02中,ORR为46.9%(95% CI:34.3,59.8),DOR为5.5个月(范围1.3+,9.7+)。
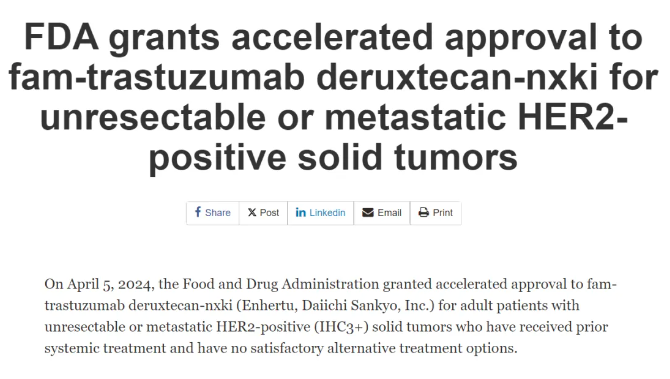
此次上市申请是基于DESTINY-PanTumor02临床数据,根据2023年ESMO披露的数据,DS-8201对于多种HER2阳性实体瘤都表现出优异疗效,267例患者覆盖子宫内膜癌、宫颈癌、卵巢癌、膀胱癌、胆管癌等多个瘤种,ORR为37.1%,mDOR为11.3个月。对于IHC 3+患者疗效更优,这也是此次获批的人群。
根据此次说明书公开的最新数据,DESTINY-PanTumor02的ORR为51.4%,中位持续缓解时间为19.4个月。

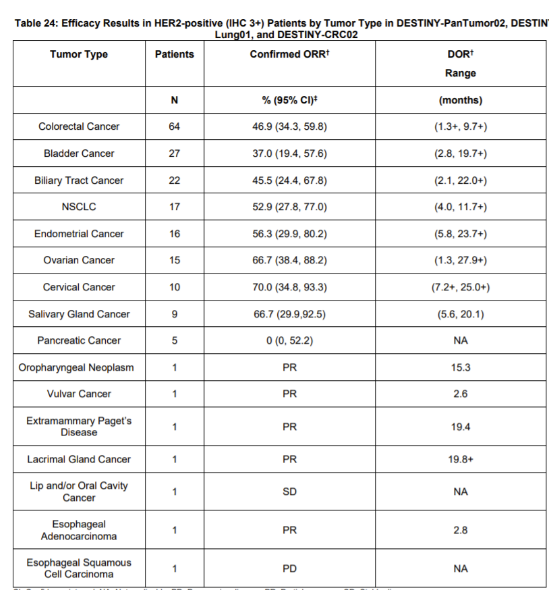
对各不同瘤种的ORR和缓解时间范围如下表。
基于此次获批,将有大批患者受益于DS-8201这款神奇的药物,肿瘤患者也将迎来革命性的疗效突破,有望迈入“治愈”的大门。
肿瘤患友们若想第一时间了解更多新药资讯,欢迎添加下方二维码咨询。也可加入“阳光易家亲–肿瘤病友群”,与上万位肿瘤患友/家属分享经验,互通有无。




 浙公网安备 33010602004553号
浙公网安备 33010602004553号


