2021年12月31日,由江苏恒瑞医药股份有限公司自主研发生产的1类新药CDK4/6抑制剂羟乙基磺酸达尔西利片(商品名:艾瑞康®)正式获国家药品监督管理局(NMPA)批准上市。
2021年4月27日,中国国家药品监督管理局药品审评中心(CDE)已受理达尔西利上市申请,该药之前先后被CDE授予突破性治疗品种和优先审评审批,而在短短8个月3天后,达尔西利便快速通过审批上市,适应症为:联合氟维司群治疗既往接受内分泌治疗后出现疾病进展的激素受体阳性(HR+)、人表皮生长因子受体2 阴性(HER2-)的复发或转移性乳腺癌患者。
中国药监管理部门基于中国创新药物的出色品质开通了突破性治疗药品的快速审核通道,以高效审核助力了中国肿瘤诊疗水平的提升。
CDK4/6抑制剂改写HR+/HER2-乳腺癌治疗格局
在全球范围内,乳腺癌是发病率最高的恶性肿瘤。HR+/HER2-则是乳腺癌的主要亚型,占所有病例的近70%。CDK4/6抑制剂的诞生大幅度提高了这部分患者的疗效,真正改写了HR+/HER2-晚期乳腺癌的治疗格局。
《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2021版)》、《中国晚期乳腺癌规范诊疗指南(2020版)》、《中国抗癌协会乳腺癌诊治指南与规范(2021版)》和《美国国立综合癌症网络(NCCN)临床实践指南:乳腺癌(2021版)》等国内外多部权威指南,均将CDK4/6抑制剂联合内分泌治疗的证据级别提升为Ⅰ级,推荐其在HR+/HER2-晚期乳腺癌的临床应用。
自2018年以来,随着进口的CDK4/6抑制剂陆续上市,已经有部分中国患者从中获益,然而中国患者的发病特征(年龄、基础疾病等)和诊疗现状较国外有一定的差异,所以,寻求更贴近、更适合中国乳腺癌患者诊疗现状的治疗方案,一直是中国临床医生关注和迫切需要解决的问题。
达尔西利上市为HR+/HER2-晚期乳腺癌创造多维度获益
达尔西利是一种新型高选择性CDK4/6抑制剂,在药物分子结构上通过经典电子等排体替换,引入哌啶结构,消除了谷胱甘肽捕获风险:谷胱甘肽具有稳定肝细胞膜,增强肝脏酶活性,促进肝脏发挥合成与解毒的功能。达尔西利哌啶结构的引入,使其成为强效且肝脏安全性更优的CDK4/6抑制剂。
在临床前研究中,达尔西利已显示出较强的抗肿瘤活性。基于此,达尔西利的临床研究随即展开。在其Ⅰb期研究中探索出150mg QD的推荐剂量,为其在HR+/HER2-乳腺癌的大规模临床试验打下基础。
此次达尔西利获批,主要是基于DAWNA-1研究 :一项多中心、随机、对照、双盲Ⅲ期临床研究,旨在对比达尔西利与安慰剂加氟维司群治疗既往经内分泌治疗复发或进展的HR+/HER2-晚期乳腺癌患者。该研究已于2021年6月在美国临床肿瘤学会(ASCO)年会中以口头报告的形式精彩亮相,中国工程院徐兵河院士作为研究PI向全球展现了首个中国原研CDK4/6抑制剂的出色疗效。2021年11月,国际学术期刊NatureMedicine(IF=53.44)全文发表了DAWNA-1研究成果,令中国智慧再度闪耀国际舞台。
DAWNA-1研究对2019年6月25日至2020年9月2日期间的547例患者进行了筛选,361例符合条件的患者按2:1的比例随机分配至达尔西利+氟维司群组(n=241)或安慰剂+氟维司群组(n=120)。主要研究终点为研究者评估的PFS,两组间的患者基线特征基本一致。总体中位年龄为51.0岁,60.1%存在内脏转移。
值得注意的是,DAWNA-1研究入组的361例患者为100%中国患者,达尔西利研究组入组人群中,27%在既往解救治疗中接受过化疗,44%为绝经前(围绝经期)人群,相比较之前进口原研药物临床入组基线特征,DAWNA-1更贴近中国患者诊疗现状,更具参考意义。
研究结果显示,研究者评估的达尔西利组和安慰剂组的中位PFS分别为15.7个月和7.2个月,中位PFS提高8.5个月。达尔西利组的进展或死亡风险降低58%[HR=0.42(0.31-0.58),P=0.00000002;排除疫情影响,HR=0.40(0.28-0.55),P<0.0001]。独立评审委员会(IRC)评估的主要终点获益与研究者评估的相一致。此外,至首次后续化疗时间的评估结果显示,与安慰剂组相比,达尔西利组至首次后续化疗时间的风险降低53%[HR=0.47,(0.32-0.69),P=0.00003555]。其中,安慰剂组至首次后续化疗时间为14.2个月,而达尔西利组尚未达到。
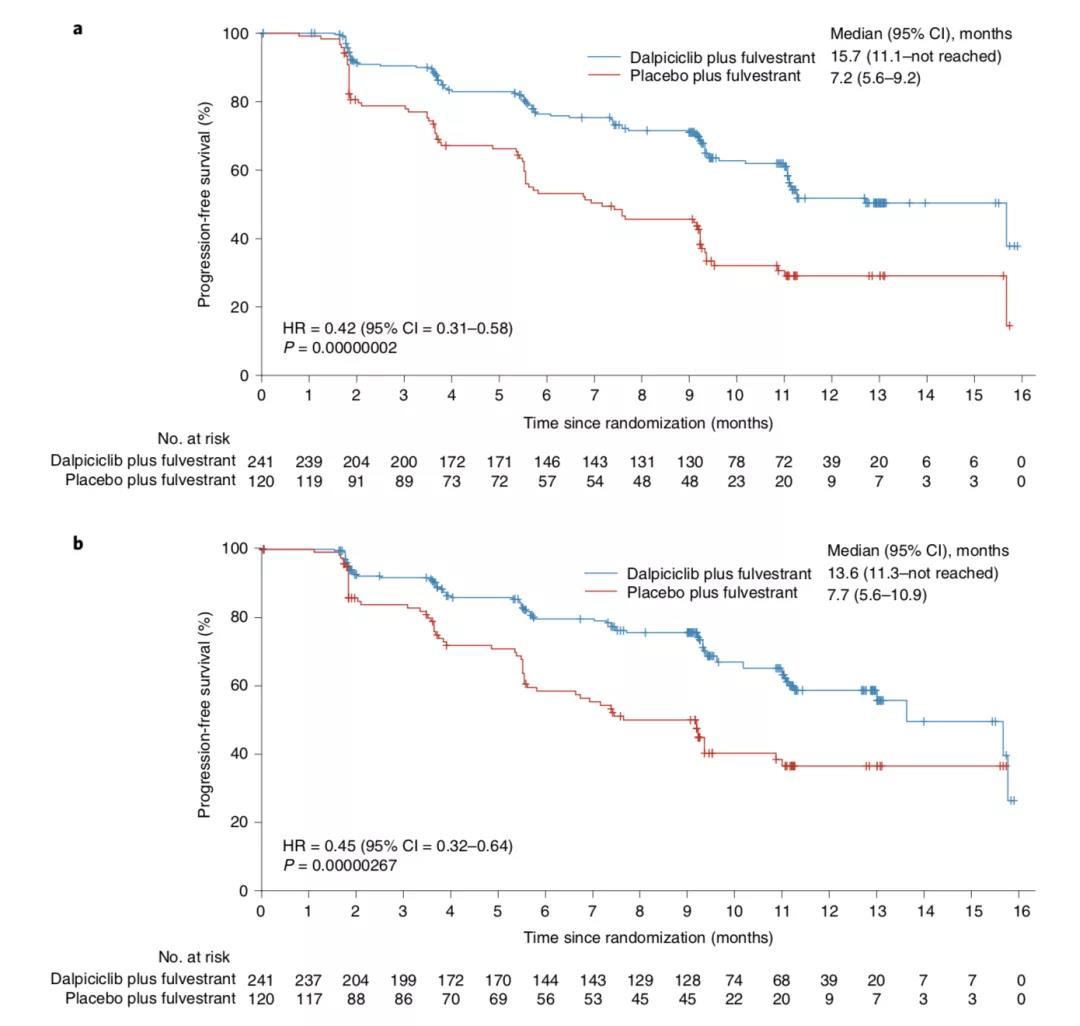
图1 达尔西利+氟维司群组与安慰剂+氟维司群组的PFS(研究者评估与IRC评估)
亚组分析发现,无论患者年龄、绝经状态、是否内脏转移、既往是否接受内分泌治疗和挽救化疗,达尔西利组与安慰剂组相比,PFS均有显著延长。由此可见,针对我国现有的HR+/HER2-晚期乳腺癌发病特点及诊疗现状,达尔西利不仅在总人群中展现出优越的治疗获益,同时深耕国情,立足实践,给中国患者带来了更适合、更有效的治疗新选择。
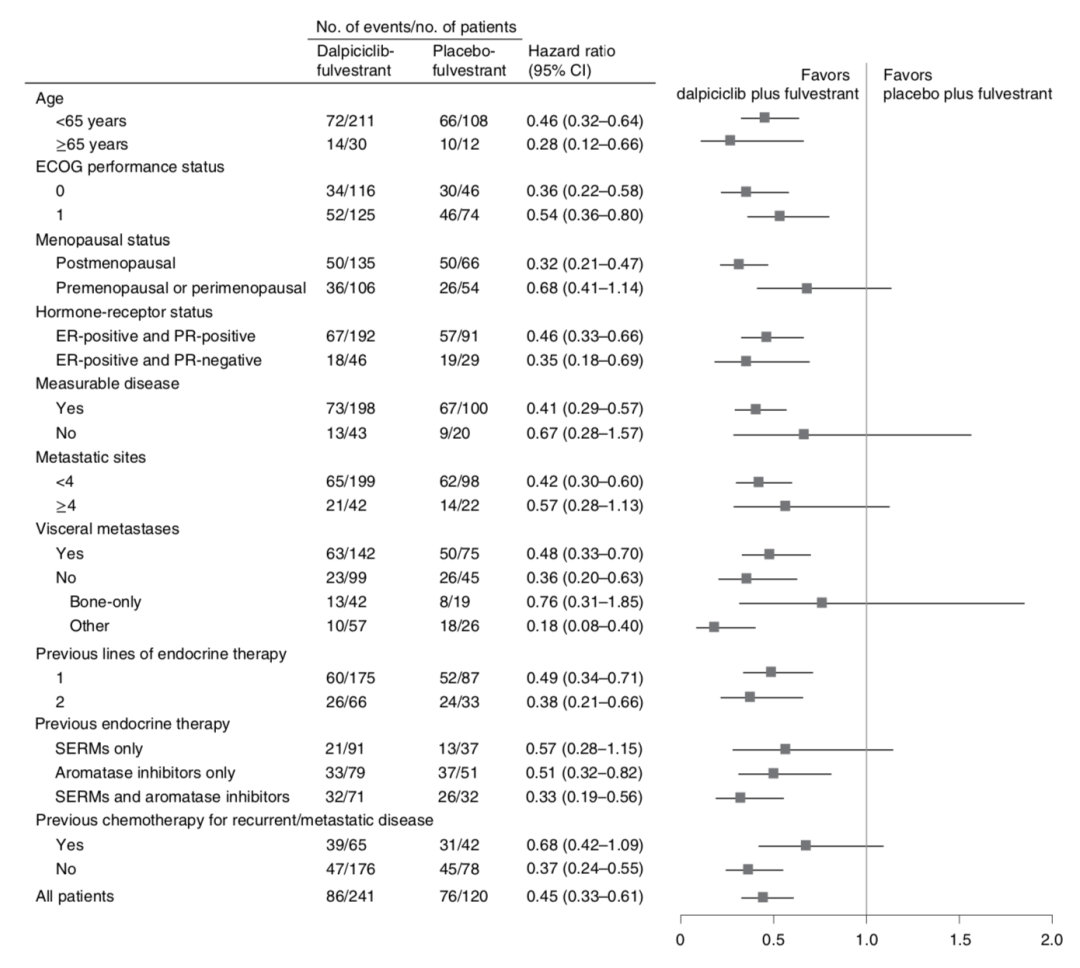
图2 亚组PFS获益
不良反应方面,达尔西利组88.3%的患者发生了3级或4级不良事件,主要为血液学不良反应,最常见的是中性粒细胞减少和白细胞减少,无发热性中性粒细胞减少的病例报告。达尔西利组3级或以上中性粒细胞减少症平均持续时间仅为3天,无因血液学不良反应而停止治疗的患者。
此外,达尔西利引入了哌啶结构,消除了谷胱甘肽捕获风险,降低了潜在的肝脏毒性,3级及以上的AST升高比例为0.4%(3级及以上ALT升高比例为0%)。肝脏安全性更优,更适合需要长期服药的乳腺癌患者。
展望未来,期待达尔西利惠及更多中国HR+患者
与欧美国家相比,我国CDK4/6抑制剂的临床应用相对滞后。有研究数据提示,中国HR+/HER2-乳腺癌患者整体使用CDK4/6抑制剂的比例仅为10%左右。作为中国首个自主研发的CDK4/6抑制剂,达尔西利强效、肝脏安全性更优、100%中国循证,其上市将有力提高CDK4/6抑制剂的应用可及性,令更多HR+/HER2-乳腺癌患者能够从规范治疗中获益,有望改写中国HR+/HER2-乳腺癌治疗格局。
值得一提的是,由中国工程院徐兵河院士牵头的达尔西利联合芳香化酶抑制剂在HR+/HER2-晚期乳腺癌的大规模临床研究DAWNA-2正在随访中;同时由复旦大学附属肿瘤医院邵志敏教授牵头的达尔西利联合内分泌术后辅助治疗的临床研究也正在进行之中;此外,由解放军总医院江泽飞教授牵头的达尔西利真实世界研究即将开启。期待这些研究数据早日出炉,令达尔西利真正成为HR+/HER2-乳腺癌患者的中国“达”案,让中国答案解决中国患者的问题。
如果您觉得这篇文章对您有帮助,欢迎关注易加医官网或下载易加医APP。易加医是专注于肿瘤领域的互联网医疗平台,为肿瘤患者和家属提供肿瘤预防、就医、诊疗、康复所需的各类服务。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


