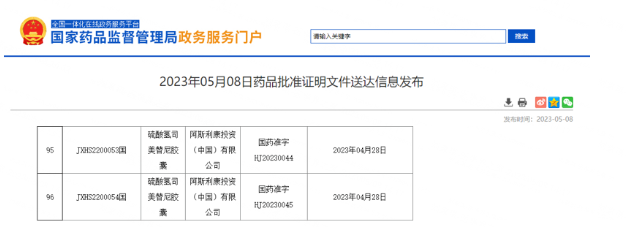
5月8日,国家药监局发布的信息显示,阿斯利康申报的硫酸氢司美替尼胶囊(中文商品名:科赛优)上市申请获得批准,适应症为治疗3岁及3岁以上伴有症状、无法手术的丛状神经纤维瘤的1型神经纤维瘤病儿童患者,是国内首个且唯一获批的Ⅰ型神经纤维瘤病治疗药物。这意味着这一罕见遗传性疾病无药可用的局面终于被打破,罹患NF1的儿童患者家庭终于看到了一线曙光。
神经纤维瘤病是一种多系统的疾病,会累及皮肤系统、神经系统、骨骼等,危害广泛,患者的平均寿命比正常人低10年-15年。在神经纤维瘤病中,Ⅰ型神经纤维瘤病最常见,全球新生儿发病率约为1/3000,多数儿童患者在10岁以下被诊断,中国暂无流行病学数据,推算发病率为5/100万,在欧美被认定为罕见病。
该疾病是因为合成神经纤维瘤蛋白的NF1基因发生突变引起,这种基因突变可扰乱RAS/MAPK信号通路(RAS-RAF-MEK-ERK),进而导致肿瘤的生长。NF1的症状包括皮肤上和皮下的软块(皮肤神经纤维瘤),皮肤色素沉积(被称为“咖啡状斑点”)。在20%-50%的NF1患者中,肿瘤在神经鞘上发展,导致丛状神经纤维瘤(PN)。PN可导致疼痛,运动功能障碍,气道功能障碍,肠/膀胱功能障碍和毁容,并有可能转变为恶性外周神经鞘瘤。
MEK是RAS/MAPK信号通路中的关键蛋白激酶。作为一款MEK抑制剂,司美替尼能够选择性地抑制MEK1和MEK2,从而让失调的信号通路恢复正常,进而缓解儿童NF1患者的病情。此前,该药已获得美国FDA授予的孤儿药资格、突破性疗法认定以及优先审评资格。2020年4月,司美替尼获FDA批准上市(商品名Koselugo)。
一项在美国国家癌症研究所开展的临床试验结果显示,司美替尼的治疗使携带无法通过手术治疗的丛状神经纤维瘤的NF1儿童患者的总缓解率(ORR)达到66%,所有患者均为部分缓解。在这些患者中,82%的患者缓解持续时间达到了12个月或更长。
临床试验结果表明,司美替尼作为一种口服激酶抑制剂,可缩小不可手术儿童患者的瘤体体积,帮助缓解疼痛、功能障碍和其他临床并发症。相较于自然史患者3年仅15%的患者无疾病进展率,研究中的患者3年无疾病进展率达到84%,患者疼痛强度平均降低2.14分,运动功能障碍得到有效改善,生活质量得到显著提升。安全性数据显示,12个治疗周期内患者用药依从性超95%,常见的不良反应是呕吐、血肌酸磷酸激酶升高、腹泻和恶心。
根据中国药物临床试验登记与信息公示平台,阿斯利康正在开展一项国际多中心(含中国)3期临床试验(KOMET),以评估司美替尼治疗存在症状、不能手术丛状神经纤维瘤的成人NF1受试者的有效性和安全性。
希望司美替尼(科赛优)早日来到患者身边,为NF1患者缓解病痛。
END
通常从获批到患者可以买到,还有几个月的时间。国内何时正式启动销售,什么价格,哪里能买到,有没有慈善赠药......请加文末二维码,我们将在第一时间将最新进展通知到您。
眼下就希望立即接受治疗的儿童患者,也可以通过香港特别行政区、海南博鳌医药先行区的医疗机构先行接受治疗。成年NF1患者,如有意参与成人患者的临床研究也同样可以咨询我们。
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,易加医不对任何主体因使用本文内容而导致的任何损失承担责任。
-参考资料-
[1]2023年05月08日药品批准证明文件送达信息发布. Retrieved May 8 , 2023. from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20230508125507185.html
[2] FDA Approves First Therapy for Children with Debilitating and Disfiguring Rare Disease. Retrieved 2020-04-11, from https://www.prnewswire.com/news-releases/fda-approves-first-therapy-for-children-with-debilitating-and-disfiguring-rare-disease-301038879.html
常常去帮助,总是在安慰,康复之路你我同行,易加医目前有多种癌症病友群扫描底部小助手微信入群,与上万位肿瘤患友/家属分享经验,互通有无。




 浙公网安备 33010602004553号
浙公网安备 33010602004553号


