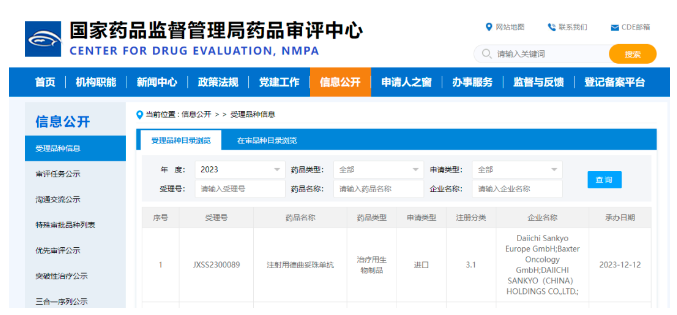
12月12日,第一三共/阿斯利康联合开发的注射用德曲妥珠单抗(DS8201)上市申请获国家药监局受理,根据此前被纳入优先审评适应症推测,此次申报适应症为:单药治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部(GEJ)腺癌患者。
德曲妥珠单抗是第一三共和阿斯利康合作开发的一款靶向HER2的抗体偶联药物(ADC),目前已在华获批2项乳腺癌适应症,包括:1)单药治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者;2)既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的HER2低表达(IHC 1+或IHC 2+/ISH-)不可切除或转移性乳腺癌成人患者。
此前,针对HER2阳性胃或胃食管结合部腺癌患者的两项关键临床试验结果已公布。在DESTINY-Gastric01研究中,经曲妥珠单抗治疗后进展的HER2阳性晚期三线及以上胃癌患者,接受T-DXd治疗后中位OS长达12.5个月,相比化疗组(8.4个月)显著延长,12个月OS率分别为52.1%和28.9%;T-DXd治疗组ORR为51.3%,是化疗组(14.3%)的3倍多。经确认的ORR分别为42.9%和12.5%,DCR为 85.7% 和 62.5%,mDOR分别为11.3和3.9个月,mPFS分别为5.6和3.5个月。
DESTINY-Gastric02研究纳入的西方人群中接受包含曲妥珠单抗的治疗后出现疾病进展的HER2+胃癌或胃食管结合部癌。结果显示,T-DXd治疗组明确的ORR为41.8%(33/79),其中CR为5.1%(4/79),PR为36.7%(29/79),SD为39.2%(31/79),明确的疾病控制率(DCR)为81.0%(64/79),中位缓解持续时间(DoR)为8.1个月,中位应答时间为1.4个月,中位OS为12.1个月,中位PFS为5.6个月。
基于DESTINY-Gastric01研究和/或DESTINY-Gastric02研究结果,德曲妥珠单抗已在30多个国家/地区获批用于治疗既往接受过基于曲妥珠单抗的治疗方案的局部晚期或转移性HER2阳性胃或胃食管交界处(GEJ)腺癌成人患者。
期待德曲妥珠单抗的新适应症尽快获批,惠及更多的患者。
截止目前,德曲妥珠单抗获美国FDA获批的适应症包含:
HER2 阳性复发或转移性乳腺癌的三线治疗;
HER2 阳性复发或转移性乳腺癌的二线治疗;
HER2 低表达的复发或转移性乳腺癌的治疗;
HER2 基因突变的转移性非小细胞肺癌的治疗;
HER2 阳性复发或转移性胃癌的治疗。
今年9月,德曲妥珠单抗再获FDA授予两项突破性疗法,包括:
既往治疗后发生进展且无替代治疗选择的不可切除或转移性HER2阳性(IHC3+)实体瘤患者;
三线及三线以上无法切除的晚期或复发性 HER2 阳性(IHC3+)结直肠癌患者。
肿瘤患友如想咨询德曲妥珠单抗的相关内容,可添加下方的二维码找到我。也可加入“阳光易家亲–肿瘤患友群”,与上万位肿瘤患友/家属分享经验,互通有无。

参考来源:医药魔方Info
文章用于科普宣教,如有侵权请联系删除。



 浙公网安备 33010602004553号
浙公网安备 33010602004553号


